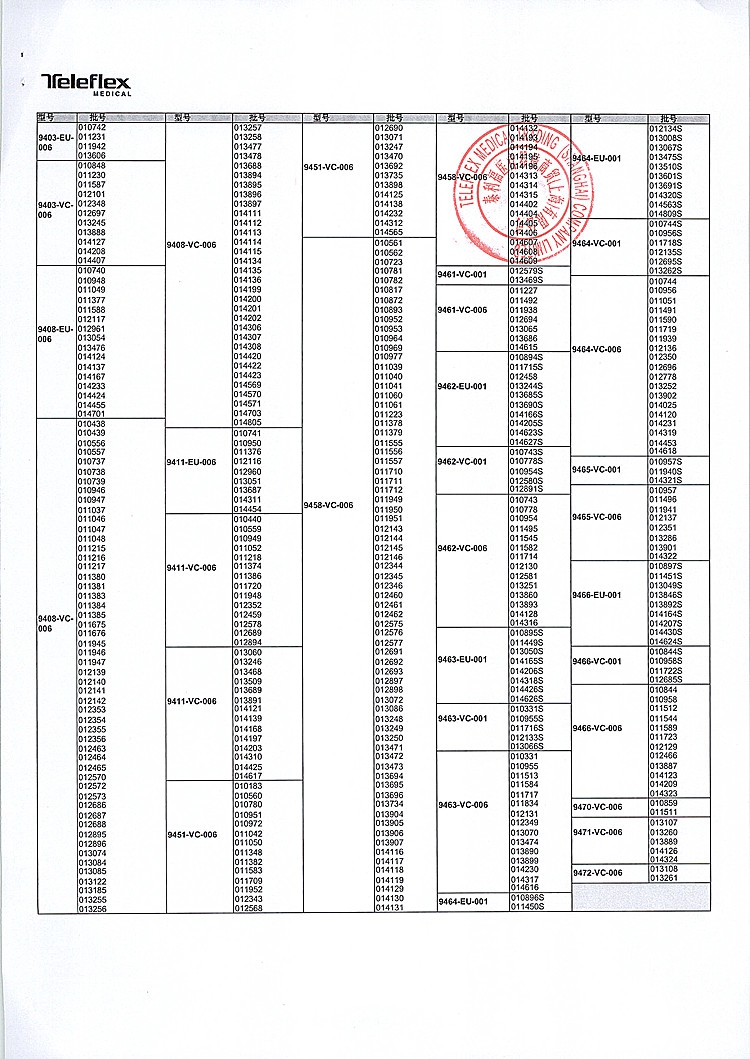
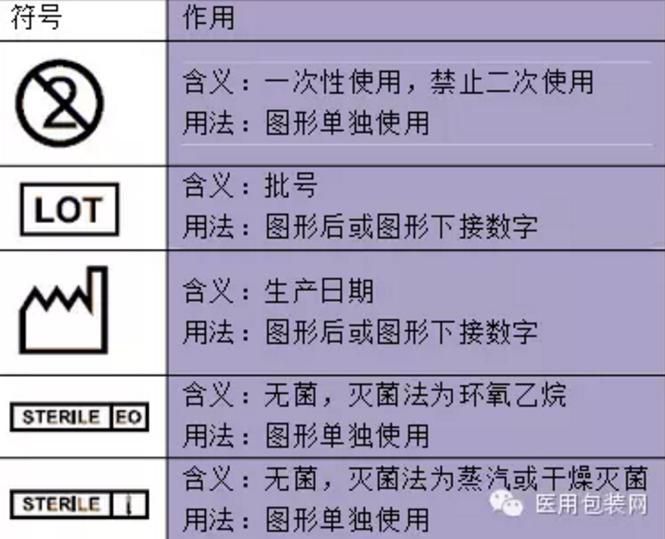
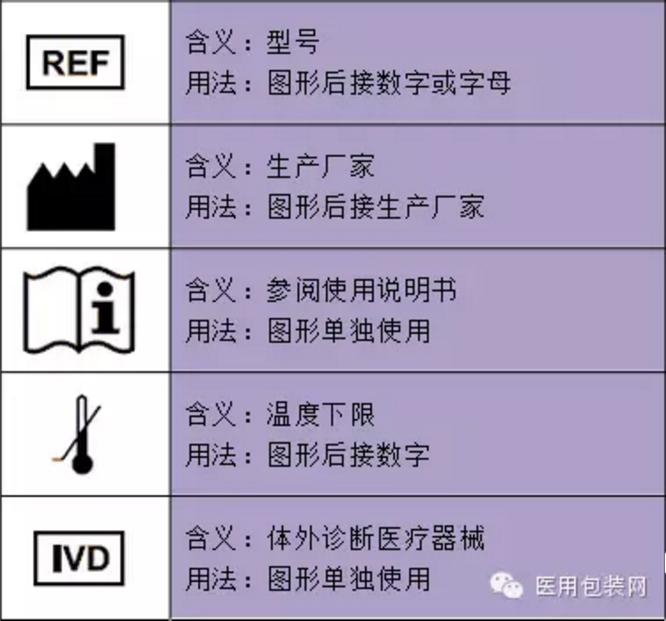
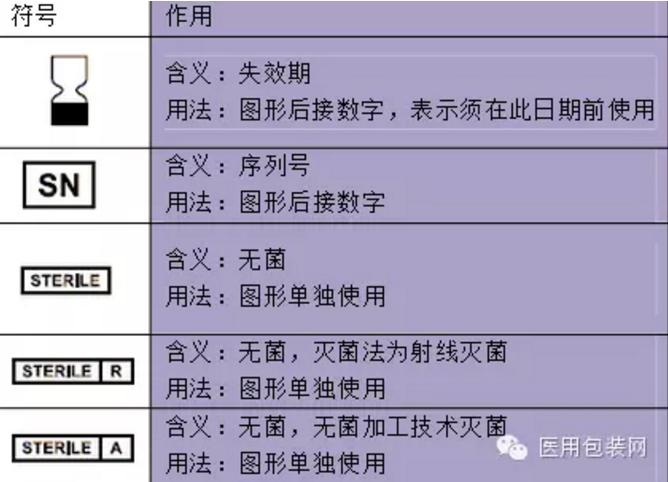
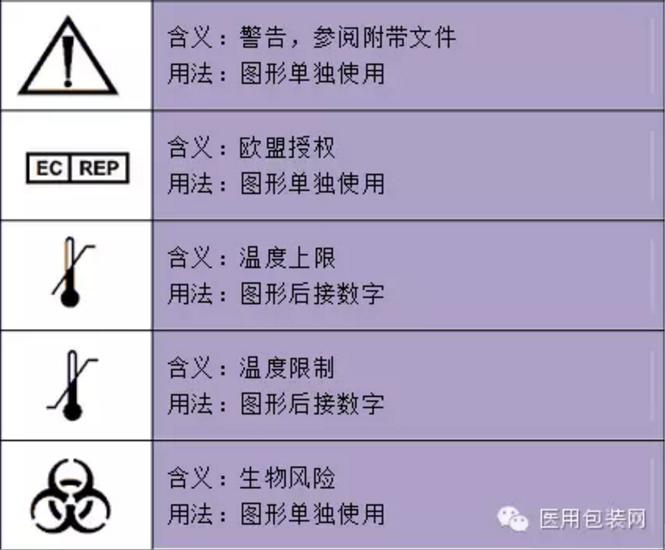
一次性医疗器械器具和消毒药械管理
转帖:发改委怒了!罚美敦力过亿元 40办案人员被困6小时
默认分类 • dearhang 发表了文章 • 0 个评论 • 240 次浏览 • 2017-01-10 14:37
山雨欲来风满楼。
7日早间,国家发改委网站公布,依法对美国美敦力公司(上海)管理有限公司(下称“美敦力”)价格垄断行为罚款1.185亿元(人民币)。
“与其交易相对人达成并实施心脏血管、恢复性疗法和糖尿病业务领域医疗器械产品价格垄断协议”,是发改委对这张医疗器械反垄断罚单给出的直接理由。
突查!对抗!
美敦力是在2015年正式进入发改委反垄断调查视线的。
根据7日午间央视新闻报道,国家发改委反垄断局处长徐新宇接受央视采访时表示——“2015年10月,国家发改委开始对美敦力的反垄断行为进行外围调查,在掌握了充分的证据后,执法人员对美敦力上海公司进行了突击检查。”
但这次突查遭到了美敦力方面的顽强对抗。
“我们40多人被美敦力中国总部困了6个多小时,9点半进去到下午4点钟,一直就是对抗。后来我们就依据法律,进入它的相关场所和营业场所进行搜查,发现它的负责人就躲在办公室里喝咖啡。” 徐新宇告诉央视记者。
问题很快被一一查出。
发改委随后公开的信息显示,至少自2014年起,美敦力通过经销协议、邮件通知、口头协商等方式,与其交易相对人(平台商和一级经销商)达成垄断协议,限定相关医疗器械产品的转售价格、投标价格和到医院的最低销售价格,并通过制定下发各经销环节的产品价格表、内部考核、撤销经销商低价中标产品等措施,实施了价格垄断协议。
与此同时,美敦力还采取了纵向限制销售对象和销售区域、限制经销竞争品牌产品的措施,进一步强化了纵向价格垄断协议的实施效果。
发改委认定,美敦力与其交易相对人达成并实施固定向第三人转售涉案产品价格、限定向第三人转售涉案产品最低价格的垄断协议,违反了《反垄断法》第十四条第一项、第二项的规定,且不符合《反垄断法》第十五条规定的豁免情形和豁免条件,国家发展改革委依法责令美敦力立即停止实施价格垄断行为,并处2015年度涉案产品销售额4%的罚款,计1.1852亿元。
器械“整风”
但这很可能并不是美敦力一家的危机时刻。
徐新宇在接受央视采访时表示,发改委对医疗器械的反垄断研究是从2013年开始的,而调研发现,医疗器械领域最大的问题就是“竞争很不充分”。
而2013年,对于中国医药行业是个敏感而重要的时点——当年6月,震惊全国的GSK商业贿赂案浮出水面,中国药品市场经历了史上最严格的行业整顿,当时就一直有声音认为,单价更高、渠道更稳固的医疗器械领域,将会是监管方整风的下一个重点。
而事实上,由于产品和渠道与医院高度的关联性,自2009年新一轮医改启动后,降低院内高值耗材的价格、降低公众检查费用负担,甚至以器械为突破口打开公立医院改革的小切口等尝试一直没有停止,而官方对医疗器械这一领域的反腐动作也在逐渐升级。
2016年国家卫计委印发《关于印发2016年纠正医药购销和医疗服务中不正之风专项治理工作要点的通知》后,对医药价格、耗材管理和商业贿赂的检查明显加大了力度,先后70多位医疗卫生系统内的官员及医院领导被立案调查
无锡近期更是有多家医院检验科医生先后被带走。
2016年8月10日,江苏省无锡市人民检察院依法对无锡市第三人民医院检验科主任潘宇红以涉嫌受贿罪决定逮捕;10月8日,江苏省无锡市检察院发布重要案件信息公开,江阴市人民医院的检验科主任、副主任、原主任,以及该院医疗器械科科长,均因涉嫌受贿罪被决定逮捕。
此外,包括扬州、连云港等多家医院相关科室负责人也均被牵涉。
而此番美敦力控价的做法在行业内并非唯一,在行业监管风向趋紧的风口下,医疗器械行业究竟会不会如同制药领域走向GSK后时代的销售模式转向?
发改委在7日在官网评价美敦力反垄断案时表示,这一案件并不特别针对美敦力一家,目前,我国高值耗材和可植入医用设备的市场竞争整体并不充分,并且厂商主要采取转售的销售方式,经销商之间的公平竞争是促进产品竞争、形成合理市场价格的重要方面。
但国家发改委特别强调,将继续加强医疗器械行业反垄断监管,制止生产、销售等环节中的各种限制竞争措施,严肃查处垄断协议、滥用市场支配地位等违法行为,切实维护公平竞争秩序,保护广大消费者的合法权益。 查看全部
山雨欲来风满楼。
7日早间,国家发改委网站公布,依法对美国美敦力公司(上海)管理有限公司(下称“美敦力”)价格垄断行为罚款1.185亿元(人民币)。
“与其交易相对人达成并实施心脏血管、恢复性疗法和糖尿病业务领域医疗器械产品价格垄断协议”,是发改委对这张医疗器械反垄断罚单给出的直接理由。
突查!对抗!
美敦力是在2015年正式进入发改委反垄断调查视线的。
根据7日午间央视新闻报道,国家发改委反垄断局处长徐新宇接受央视采访时表示——“2015年10月,国家发改委开始对美敦力的反垄断行为进行外围调查,在掌握了充分的证据后,执法人员对美敦力上海公司进行了突击检查。”
但这次突查遭到了美敦力方面的顽强对抗。
“我们40多人被美敦力中国总部困了6个多小时,9点半进去到下午4点钟,一直就是对抗。后来我们就依据法律,进入它的相关场所和营业场所进行搜查,发现它的负责人就躲在办公室里喝咖啡。” 徐新宇告诉央视记者。
问题很快被一一查出。
发改委随后公开的信息显示,至少自2014年起,美敦力通过经销协议、邮件通知、口头协商等方式,与其交易相对人(平台商和一级经销商)达成垄断协议,限定相关医疗器械产品的转售价格、投标价格和到医院的最低销售价格,并通过制定下发各经销环节的产品价格表、内部考核、撤销经销商低价中标产品等措施,实施了价格垄断协议。
与此同时,美敦力还采取了纵向限制销售对象和销售区域、限制经销竞争品牌产品的措施,进一步强化了纵向价格垄断协议的实施效果。
发改委认定,美敦力与其交易相对人达成并实施固定向第三人转售涉案产品价格、限定向第三人转售涉案产品最低价格的垄断协议,违反了《反垄断法》第十四条第一项、第二项的规定,且不符合《反垄断法》第十五条规定的豁免情形和豁免条件,国家发展改革委依法责令美敦力立即停止实施价格垄断行为,并处2015年度涉案产品销售额4%的罚款,计1.1852亿元。
器械“整风”
但这很可能并不是美敦力一家的危机时刻。
徐新宇在接受央视采访时表示,发改委对医疗器械的反垄断研究是从2013年开始的,而调研发现,医疗器械领域最大的问题就是“竞争很不充分”。
而2013年,对于中国医药行业是个敏感而重要的时点——当年6月,震惊全国的GSK商业贿赂案浮出水面,中国药品市场经历了史上最严格的行业整顿,当时就一直有声音认为,单价更高、渠道更稳固的医疗器械领域,将会是监管方整风的下一个重点。
而事实上,由于产品和渠道与医院高度的关联性,自2009年新一轮医改启动后,降低院内高值耗材的价格、降低公众检查费用负担,甚至以器械为突破口打开公立医院改革的小切口等尝试一直没有停止,而官方对医疗器械这一领域的反腐动作也在逐渐升级。
2016年国家卫计委印发《关于印发2016年纠正医药购销和医疗服务中不正之风专项治理工作要点的通知》后,对医药价格、耗材管理和商业贿赂的检查明显加大了力度,先后70多位医疗卫生系统内的官员及医院领导被立案调查
无锡近期更是有多家医院检验科医生先后被带走。
2016年8月10日,江苏省无锡市人民检察院依法对无锡市第三人民医院检验科主任潘宇红以涉嫌受贿罪决定逮捕;10月8日,江苏省无锡市检察院发布重要案件信息公开,江阴市人民医院的检验科主任、副主任、原主任,以及该院医疗器械科科长,均因涉嫌受贿罪被决定逮捕。
此外,包括扬州、连云港等多家医院相关科室负责人也均被牵涉。
而此番美敦力控价的做法在行业内并非唯一,在行业监管风向趋紧的风口下,医疗器械行业究竟会不会如同制药领域走向GSK后时代的销售模式转向?
发改委在7日在官网评价美敦力反垄断案时表示,这一案件并不特别针对美敦力一家,目前,我国高值耗材和可植入医用设备的市场竞争整体并不充分,并且厂商主要采取转售的销售方式,经销商之间的公平竞争是促进产品竞争、形成合理市场价格的重要方面。
但国家发改委特别强调,将继续加强医疗器械行业反垄断监管,制止生产、销售等环节中的各种限制竞争措施,严肃查处垄断协议、滥用市场支配地位等违法行为,切实维护公平竞争秩序,保护广大消费者的合法权益。
江西省医疗机构外来医疗器械及植入物管理规定(试行)
默认分类 • dearhang 发表了文章 • 0 个评论 • 238 次浏览 • 2017-01-10 14:32
相关网址:http://www.jxwst.gov.cn/cszw/y ... 3.htm
http://www.jxwst.gov.cn/cszw/y ... 4.htm
查看全部
2015年7月28日,江西省卫计委发布了《江西省医疗机构外来医疗器械及植入物管理规定(试行)》。《规定》共有十条,对医疗机构外来医疗器械及植入物提出了管理要求,并明确了器械管理部门、护理管理部门、医院感染管理部门、消毒供应中心、手术室和临床手术科室等部门的职责,另附有医疗机构外来医疗器械及植入物清洗要点。
相关网址:http://www.jxwst.gov.cn/cszw/y ... 3.htm
http://www.jxwst.gov.cn/cszw/y ... 4.htm
12月1日发布国家医疗器械抽验不符合标准规定产品名单含一次性用品
默认分类 • dearhang 发表了文章 • 0 个评论 • 179 次浏览 • 2017-01-10 14:29
国家医疗器械质量公告(2016年第9期,总第17期)
2016年12月01日 发布
为加强医疗器械质量监督管理,保障医疗器械产品使用安全有效,国家食品药品监督管理总局组织对天然胶乳橡胶避孕套、软性接触镜、一次性使用静脉留置针等5个品种184批(台)的产品进行了质量监督抽验。现将抽验结果公告如下:
一、被抽验项目不符合标准规定的医疗器械产品,涉及7家医疗器械生产企业的4个品种8批次。具体为:
(一)软性接触镜1家企业1批次产品。晶硕光学股份有限公司生产的1批次软性亲水接触镜,紫外光区要求(适用时)不符合标准规定。
(二)一次性使用无菌阴道扩张器2家企业3批次产品。陕西富源医用塑料有限公司生产的2批次、江西益康医疗器械集团有限公司生产的1批次一次性使用无菌阴道扩张器,外观不符合标准规定。
(三)天然胶乳橡胶避孕套2家企业2批次产品。河北维妮德橡胶制品有限公司、茂名市江源乳胶制品有限公司生产的各1批次天然胶乳橡胶避孕套,未经老化爆破体积和爆破压力、针孔不符合标准规定。
(四)一次性使用静脉留置针2家企业2批次产品。新乡市驼人医疗器械有限公司生产的1批次一次性使用静脉留置针,紫外吸光度不符合标准规定;江苏阳普医疗科技有限公司生产的1批次一次性使用静脉留置针,流速不符合标准规定。
以上抽验不符合标准规定产品具体情况,见附件1。
二、被抽验项目为标识标签、说明书等项目不符合标准规定的医疗器械产品,涉及4家医疗器械生产企业的2个品种4批(台),具体为:
(一)B型超声诊断设备2家企业2台产品。宜兴市万康医疗电子有限公司生产的1台全数字彩色多普勒超声诊断仪、北京汇影互联科技有限公司生产的1台全数字彩色多普勒超声诊断系统,技术说明书不符合标准规定。
(二)天然胶乳橡胶避孕套2家企业2批次产品。青岛双蝶集团股份有限公司、施梦(天津)乳胶有限公司生产的各1批次天然胶乳橡胶避孕套,包装和标志不符合标准规定。
以上抽验不符合标准规定产品具体情况,见附件2。
三、抽验项目全部符合标准规定的医疗器械产品涉及1个品种172批次,见附件3。
四、对上述抽验中发现的不符合标准规定产品,国家食品药品监督管理总局已要求企业所在地食品药品监督管理部门按照《医疗器械监督管理条例》及《食品药品监管总局办公厅关于进一步加强医疗器械抽验工作的通知》(食药监办械监〔2016〕9号),对相关企业进行调查处理。
相关医疗器械生产企业应对不符合标准规定产品、不符合标准规定项目进行风险评估,根据医疗器械缺陷的严重程度确定召回级别,主动召回并公开召回信息。企业所在地食品药品监督管理部门要对企业召回情况进行监督,未组织召回的应责令召回;如发现不符合标准规定医疗器械产品对人体造成伤害或者有证据证明可能危害人体健康的,可以采取暂停生产、进口、经营、使用的紧急控制措施。
相关省级食品药品监督管理部门要督促企业尽快查明原因,制定整改措施并按期整改到位,有关处置情况于2016年12月30日前向社会公布。
特此公告。
附件:1.国家医疗器械抽验不符合标准规定产品名单
2.国家医疗器械抽验(标识标签说明书等项目)不符合标准规定产品名单
3.国家医疗器械抽验符合标准规定产品名单
食品药品监管总局
2016年11月28日 查看全部
国家医疗器械质量公告(2016年第9期,总第17期)
2016年12月01日 发布
为加强医疗器械质量监督管理,保障医疗器械产品使用安全有效,国家食品药品监督管理总局组织对天然胶乳橡胶避孕套、软性接触镜、一次性使用静脉留置针等5个品种184批(台)的产品进行了质量监督抽验。现将抽验结果公告如下:
一、被抽验项目不符合标准规定的医疗器械产品,涉及7家医疗器械生产企业的4个品种8批次。具体为:
(一)软性接触镜1家企业1批次产品。晶硕光学股份有限公司生产的1批次软性亲水接触镜,紫外光区要求(适用时)不符合标准规定。
(二)一次性使用无菌阴道扩张器2家企业3批次产品。陕西富源医用塑料有限公司生产的2批次、江西益康医疗器械集团有限公司生产的1批次一次性使用无菌阴道扩张器,外观不符合标准规定。
(三)天然胶乳橡胶避孕套2家企业2批次产品。河北维妮德橡胶制品有限公司、茂名市江源乳胶制品有限公司生产的各1批次天然胶乳橡胶避孕套,未经老化爆破体积和爆破压力、针孔不符合标准规定。
(四)一次性使用静脉留置针2家企业2批次产品。新乡市驼人医疗器械有限公司生产的1批次一次性使用静脉留置针,紫外吸光度不符合标准规定;江苏阳普医疗科技有限公司生产的1批次一次性使用静脉留置针,流速不符合标准规定。
以上抽验不符合标准规定产品具体情况,见附件1。
二、被抽验项目为标识标签、说明书等项目不符合标准规定的医疗器械产品,涉及4家医疗器械生产企业的2个品种4批(台),具体为:
(一)B型超声诊断设备2家企业2台产品。宜兴市万康医疗电子有限公司生产的1台全数字彩色多普勒超声诊断仪、北京汇影互联科技有限公司生产的1台全数字彩色多普勒超声诊断系统,技术说明书不符合标准规定。
(二)天然胶乳橡胶避孕套2家企业2批次产品。青岛双蝶集团股份有限公司、施梦(天津)乳胶有限公司生产的各1批次天然胶乳橡胶避孕套,包装和标志不符合标准规定。
以上抽验不符合标准规定产品具体情况,见附件2。
三、抽验项目全部符合标准规定的医疗器械产品涉及1个品种172批次,见附件3。
四、对上述抽验中发现的不符合标准规定产品,国家食品药品监督管理总局已要求企业所在地食品药品监督管理部门按照《医疗器械监督管理条例》及《食品药品监管总局办公厅关于进一步加强医疗器械抽验工作的通知》(食药监办械监〔2016〕9号),对相关企业进行调查处理。
相关医疗器械生产企业应对不符合标准规定产品、不符合标准规定项目进行风险评估,根据医疗器械缺陷的严重程度确定召回级别,主动召回并公开召回信息。企业所在地食品药品监督管理部门要对企业召回情况进行监督,未组织召回的应责令召回;如发现不符合标准规定医疗器械产品对人体造成伤害或者有证据证明可能危害人体健康的,可以采取暂停生产、进口、经营、使用的紧急控制措施。
相关省级食品药品监督管理部门要督促企业尽快查明原因,制定整改措施并按期整改到位,有关处置情况于2016年12月30日前向社会公布。
特此公告。
附件:1.国家医疗器械抽验不符合标准规定产品名单
2.国家医疗器械抽验(标识标签说明书等项目)不符合标准规定产品名单
3.国家医疗器械抽验符合标准规定产品名单
食品药品监管总局
2016年11月28日
Vidacare Corporation对骨髓活检针进行召回2016年12月05日发布
默认分类 • dearhang 发表了文章 • 0 个评论 • 219 次浏览 • 2017-01-10 14:29
下载 打印 分享到新浪微博 分享到腾讯微博 分享到QQ空间 分享到微信
2016年12月05日 发布
泰利福医疗器械商贸(上海)有限公司报告,该公司代理的骨髓活检针(注册证编号:国食药监械(进)字2014第3154576号),由于外部无菌包装存在潜在的不完全密封。其生产商Vidacare Corporation对该产品进行主动召回,该公司称本次召回产品未在中国销售。请各省、自治区、直辖市食品药品监督管理局加强对此类产品的监督管理。
查看全部
一次性医疗器械真的一次性使用吗?
默认分类 • dearhang 发表了文章 • 0 个评论 • 210 次浏览 • 2017-01-10 14:27
一、 未使用过,发现过期后重新打包进行灭菌
代表物品:一次性气管插管、一次性口咽通道、一次性牙垫等
原因:科室使用量特别少的科室(有的科室或基层医院甚至一年都不曾使用)存在重复灭菌,但护理抢救车又是必备物品,所以,对未使用过的考虑成本只能重新打包灭菌。
二、 开错型号,或打开后发现型号不对(医生及护士)
代表物品:猪尾巴管、支架管、斑马导丝等
原因:由于患者的特殊性,按照常规选择型号后与患者又不符合,只能再打开另一型号的,但之前的型号患者又不能都收费,所以考虑成本对之前开错型号,未使用的重新打包灭菌。
三、 费用昂贵,无法收回成本
代表物品:手术室超声刀、立克速等(成本近万元以上)
原因:物品成本很高,有的万元以上,但基本收费不到20%,所以成本收不上,只能重复灭菌使用。 查看全部
一、 未使用过,发现过期后重新打包进行灭菌
代表物品:一次性气管插管、一次性口咽通道、一次性牙垫等
原因:科室使用量特别少的科室(有的科室或基层医院甚至一年都不曾使用)存在重复灭菌,但护理抢救车又是必备物品,所以,对未使用过的考虑成本只能重新打包灭菌。
二、 开错型号,或打开后发现型号不对(医生及护士)
代表物品:猪尾巴管、支架管、斑马导丝等
原因:由于患者的特殊性,按照常规选择型号后与患者又不符合,只能再打开另一型号的,但之前的型号患者又不能都收费,所以考虑成本对之前开错型号,未使用的重新打包灭菌。
三、 费用昂贵,无法收回成本
代表物品:手术室超声刀、立克速等(成本近万元以上)
原因:物品成本很高,有的万元以上,但基本收费不到20%,所以成本收不上,只能重复灭菌使用。
临床常用无菌物品开启日期及更换时间
默认分类 • dearhang 发表了文章 • 0 个评论 • 425 次浏览 • 2017-01-10 14:23
1、开启的无菌液体24小时?与开启的静脉输入用无菌液体须注明开启日期和时间,放置时间超过2小时后不得使用不相符,应改为2小时;
2、开启的原装碘伏小瓶,应加上酒精(一次性小包装的瓶装碘酒、酒精)1周;
3、开启快速手消毒液酒精1个月、碘伏2个月;
4、开启的无菌棉签、棉球、纱布等,不是4小时,应为24小时;
4、无菌持物钳、无菌盘,还应加上裸露灭菌后存放器械4小时
部分依据:
《基层医疗机构医院感染管理基本要求》
四、重点环节
(一)安全注射
4.抽出的药液、开启的静脉输入用无菌液体须注明开启日期和时间,放置时间超过2小时后不得使用;启封抽吸的各种溶媒超过24小时不得使用。灭菌物品(棉球、纱布等)一经打开,使用时间不得超过24小时,提倡使用小包装。
5.盛放用于皮肤消毒的非一次性使用的碘酒、酒精的容器等应密闭保存,每周更换2次,同时更换灭菌容器。一次性小包装的瓶装碘酒、酒精,启封后使用时间不超过7天。
GB,27950-2011 手消毒剂卫生要求
4.2.5 开瓶后使用有效期
4.2.5.1 在使用有效期内消毒剂有效含量不低于成品标示有效含量的下限值。
4.2.5.2 易挥发性的醇类产品开瓶后的使用期不超过30d。
4.2.5.3 不易挥发的产品开瓶后的使用期不超60d。
医疗机构口腔诊疗器械消毒技术操作规范
第十四条 根据采用的消毒与灭菌的不同方式对口腔诊疗器械进行包装,并在包装外注明消毒日期、有效期。
采用快速卡式压力蒸汽灭菌器灭菌器械,可不封袋包装,裸露灭菌后存放于无菌容器中备用;一经打开使用,有效期不得超过4小时。
查看全部
1、开启的无菌液体24小时?与开启的静脉输入用无菌液体须注明开启日期和时间,放置时间超过2小时后不得使用不相符,应改为2小时;
2、开启的原装碘伏小瓶,应加上酒精(一次性小包装的瓶装碘酒、酒精)1周;
3、开启快速手消毒液酒精1个月、碘伏2个月;
4、开启的无菌棉签、棉球、纱布等,不是4小时,应为24小时;
4、无菌持物钳、无菌盘,还应加上裸露灭菌后存放器械4小时
部分依据:
《基层医疗机构医院感染管理基本要求》
四、重点环节
(一)安全注射
4.抽出的药液、开启的静脉输入用无菌液体须注明开启日期和时间,放置时间超过2小时后不得使用;启封抽吸的各种溶媒超过24小时不得使用。灭菌物品(棉球、纱布等)一经打开,使用时间不得超过24小时,提倡使用小包装。
5.盛放用于皮肤消毒的非一次性使用的碘酒、酒精的容器等应密闭保存,每周更换2次,同时更换灭菌容器。一次性小包装的瓶装碘酒、酒精,启封后使用时间不超过7天。
GB,27950-2011 手消毒剂卫生要求
4.2.5 开瓶后使用有效期
4.2.5.1 在使用有效期内消毒剂有效含量不低于成品标示有效含量的下限值。
4.2.5.2 易挥发性的醇类产品开瓶后的使用期不超过30d。
4.2.5.3 不易挥发的产品开瓶后的使用期不超60d。
医疗机构口腔诊疗器械消毒技术操作规范
第十四条 根据采用的消毒与灭菌的不同方式对口腔诊疗器械进行包装,并在包装外注明消毒日期、有效期。
采用快速卡式压力蒸汽灭菌器灭菌器械,可不封袋包装,裸露灭菌后存放于无菌容器中备用;一经打开使用,有效期不得超过4小时。
对购入消毒药械、一次性使用医疗、卫生用品等进行审核,需要索取什么相关证件
回复默认分类 • 匿名用户 回复了问题 • 1 人关注 • 1 个回复 • 499 次浏览 • 2017-01-10 14:17
院感科审证的范围是哪些?有无规范明确说明?是不是小至棉签棉球都要审?
回复默认分类 • 匿名用户 回复了问题 • 1 人关注 • 1 个回复 • 413 次浏览 • 2017-01-10 14:09
转帖:发改委怒了!罚美敦力过亿元 40办案人员被困6小时
默认分类 • dearhang 发表了文章 • 0 个评论 • 240 次浏览 • 2017-01-10 14:37
山雨欲来风满楼。
7日早间,国家发改委网站公布,依法对美国美敦力公司(上海)管理有限公司(下称“美敦力”)价格垄断行为罚款1.185亿元(人民币)。
“与其交易相对人达成并实施心脏血管、恢复性疗法和糖尿病业务领域医疗器械产品价格垄断协议”,是发改委对这张医疗器械反垄断罚单给出的直接理由。
突查!对抗!
美敦力是在2015年正式进入发改委反垄断调查视线的。
根据7日午间央视新闻报道,国家发改委反垄断局处长徐新宇接受央视采访时表示——“2015年10月,国家发改委开始对美敦力的反垄断行为进行外围调查,在掌握了充分的证据后,执法人员对美敦力上海公司进行了突击检查。”
但这次突查遭到了美敦力方面的顽强对抗。
“我们40多人被美敦力中国总部困了6个多小时,9点半进去到下午4点钟,一直就是对抗。后来我们就依据法律,进入它的相关场所和营业场所进行搜查,发现它的负责人就躲在办公室里喝咖啡。” 徐新宇告诉央视记者。
问题很快被一一查出。
发改委随后公开的信息显示,至少自2014年起,美敦力通过经销协议、邮件通知、口头协商等方式,与其交易相对人(平台商和一级经销商)达成垄断协议,限定相关医疗器械产品的转售价格、投标价格和到医院的最低销售价格,并通过制定下发各经销环节的产品价格表、内部考核、撤销经销商低价中标产品等措施,实施了价格垄断协议。
与此同时,美敦力还采取了纵向限制销售对象和销售区域、限制经销竞争品牌产品的措施,进一步强化了纵向价格垄断协议的实施效果。
发改委认定,美敦力与其交易相对人达成并实施固定向第三人转售涉案产品价格、限定向第三人转售涉案产品最低价格的垄断协议,违反了《反垄断法》第十四条第一项、第二项的规定,且不符合《反垄断法》第十五条规定的豁免情形和豁免条件,国家发展改革委依法责令美敦力立即停止实施价格垄断行为,并处2015年度涉案产品销售额4%的罚款,计1.1852亿元。
器械“整风”
但这很可能并不是美敦力一家的危机时刻。
徐新宇在接受央视采访时表示,发改委对医疗器械的反垄断研究是从2013年开始的,而调研发现,医疗器械领域最大的问题就是“竞争很不充分”。
而2013年,对于中国医药行业是个敏感而重要的时点——当年6月,震惊全国的GSK商业贿赂案浮出水面,中国药品市场经历了史上最严格的行业整顿,当时就一直有声音认为,单价更高、渠道更稳固的医疗器械领域,将会是监管方整风的下一个重点。
而事实上,由于产品和渠道与医院高度的关联性,自2009年新一轮医改启动后,降低院内高值耗材的价格、降低公众检查费用负担,甚至以器械为突破口打开公立医院改革的小切口等尝试一直没有停止,而官方对医疗器械这一领域的反腐动作也在逐渐升级。
2016年国家卫计委印发《关于印发2016年纠正医药购销和医疗服务中不正之风专项治理工作要点的通知》后,对医药价格、耗材管理和商业贿赂的检查明显加大了力度,先后70多位医疗卫生系统内的官员及医院领导被立案调查
无锡近期更是有多家医院检验科医生先后被带走。
2016年8月10日,江苏省无锡市人民检察院依法对无锡市第三人民医院检验科主任潘宇红以涉嫌受贿罪决定逮捕;10月8日,江苏省无锡市检察院发布重要案件信息公开,江阴市人民医院的检验科主任、副主任、原主任,以及该院医疗器械科科长,均因涉嫌受贿罪被决定逮捕。
此外,包括扬州、连云港等多家医院相关科室负责人也均被牵涉。
而此番美敦力控价的做法在行业内并非唯一,在行业监管风向趋紧的风口下,医疗器械行业究竟会不会如同制药领域走向GSK后时代的销售模式转向?
发改委在7日在官网评价美敦力反垄断案时表示,这一案件并不特别针对美敦力一家,目前,我国高值耗材和可植入医用设备的市场竞争整体并不充分,并且厂商主要采取转售的销售方式,经销商之间的公平竞争是促进产品竞争、形成合理市场价格的重要方面。
但国家发改委特别强调,将继续加强医疗器械行业反垄断监管,制止生产、销售等环节中的各种限制竞争措施,严肃查处垄断协议、滥用市场支配地位等违法行为,切实维护公平竞争秩序,保护广大消费者的合法权益。 查看全部
山雨欲来风满楼。
7日早间,国家发改委网站公布,依法对美国美敦力公司(上海)管理有限公司(下称“美敦力”)价格垄断行为罚款1.185亿元(人民币)。
“与其交易相对人达成并实施心脏血管、恢复性疗法和糖尿病业务领域医疗器械产品价格垄断协议”,是发改委对这张医疗器械反垄断罚单给出的直接理由。
突查!对抗!
美敦力是在2015年正式进入发改委反垄断调查视线的。
根据7日午间央视新闻报道,国家发改委反垄断局处长徐新宇接受央视采访时表示——“2015年10月,国家发改委开始对美敦力的反垄断行为进行外围调查,在掌握了充分的证据后,执法人员对美敦力上海公司进行了突击检查。”
但这次突查遭到了美敦力方面的顽强对抗。
“我们40多人被美敦力中国总部困了6个多小时,9点半进去到下午4点钟,一直就是对抗。后来我们就依据法律,进入它的相关场所和营业场所进行搜查,发现它的负责人就躲在办公室里喝咖啡。” 徐新宇告诉央视记者。
问题很快被一一查出。
发改委随后公开的信息显示,至少自2014年起,美敦力通过经销协议、邮件通知、口头协商等方式,与其交易相对人(平台商和一级经销商)达成垄断协议,限定相关医疗器械产品的转售价格、投标价格和到医院的最低销售价格,并通过制定下发各经销环节的产品价格表、内部考核、撤销经销商低价中标产品等措施,实施了价格垄断协议。
与此同时,美敦力还采取了纵向限制销售对象和销售区域、限制经销竞争品牌产品的措施,进一步强化了纵向价格垄断协议的实施效果。
发改委认定,美敦力与其交易相对人达成并实施固定向第三人转售涉案产品价格、限定向第三人转售涉案产品最低价格的垄断协议,违反了《反垄断法》第十四条第一项、第二项的规定,且不符合《反垄断法》第十五条规定的豁免情形和豁免条件,国家发展改革委依法责令美敦力立即停止实施价格垄断行为,并处2015年度涉案产品销售额4%的罚款,计1.1852亿元。
器械“整风”
但这很可能并不是美敦力一家的危机时刻。
徐新宇在接受央视采访时表示,发改委对医疗器械的反垄断研究是从2013年开始的,而调研发现,医疗器械领域最大的问题就是“竞争很不充分”。
而2013年,对于中国医药行业是个敏感而重要的时点——当年6月,震惊全国的GSK商业贿赂案浮出水面,中国药品市场经历了史上最严格的行业整顿,当时就一直有声音认为,单价更高、渠道更稳固的医疗器械领域,将会是监管方整风的下一个重点。
而事实上,由于产品和渠道与医院高度的关联性,自2009年新一轮医改启动后,降低院内高值耗材的价格、降低公众检查费用负担,甚至以器械为突破口打开公立医院改革的小切口等尝试一直没有停止,而官方对医疗器械这一领域的反腐动作也在逐渐升级。
2016年国家卫计委印发《关于印发2016年纠正医药购销和医疗服务中不正之风专项治理工作要点的通知》后,对医药价格、耗材管理和商业贿赂的检查明显加大了力度,先后70多位医疗卫生系统内的官员及医院领导被立案调查
无锡近期更是有多家医院检验科医生先后被带走。
2016年8月10日,江苏省无锡市人民检察院依法对无锡市第三人民医院检验科主任潘宇红以涉嫌受贿罪决定逮捕;10月8日,江苏省无锡市检察院发布重要案件信息公开,江阴市人民医院的检验科主任、副主任、原主任,以及该院医疗器械科科长,均因涉嫌受贿罪被决定逮捕。
此外,包括扬州、连云港等多家医院相关科室负责人也均被牵涉。
而此番美敦力控价的做法在行业内并非唯一,在行业监管风向趋紧的风口下,医疗器械行业究竟会不会如同制药领域走向GSK后时代的销售模式转向?
发改委在7日在官网评价美敦力反垄断案时表示,这一案件并不特别针对美敦力一家,目前,我国高值耗材和可植入医用设备的市场竞争整体并不充分,并且厂商主要采取转售的销售方式,经销商之间的公平竞争是促进产品竞争、形成合理市场价格的重要方面。
但国家发改委特别强调,将继续加强医疗器械行业反垄断监管,制止生产、销售等环节中的各种限制竞争措施,严肃查处垄断协议、滥用市场支配地位等违法行为,切实维护公平竞争秩序,保护广大消费者的合法权益。
江西省医疗机构外来医疗器械及植入物管理规定(试行)
默认分类 • dearhang 发表了文章 • 0 个评论 • 238 次浏览 • 2017-01-10 14:32
相关网址:http://www.jxwst.gov.cn/cszw/y ... 3.htm
http://www.jxwst.gov.cn/cszw/y ... 4.htm
查看全部
2015年7月28日,江西省卫计委发布了《江西省医疗机构外来医疗器械及植入物管理规定(试行)》。《规定》共有十条,对医疗机构外来医疗器械及植入物提出了管理要求,并明确了器械管理部门、护理管理部门、医院感染管理部门、消毒供应中心、手术室和临床手术科室等部门的职责,另附有医疗机构外来医疗器械及植入物清洗要点。
相关网址:http://www.jxwst.gov.cn/cszw/y ... 3.htm
http://www.jxwst.gov.cn/cszw/y ... 4.htm
12月1日发布国家医疗器械抽验不符合标准规定产品名单含一次性用品
默认分类 • dearhang 发表了文章 • 0 个评论 • 179 次浏览 • 2017-01-10 14:29
国家医疗器械质量公告(2016年第9期,总第17期)
2016年12月01日 发布
为加强医疗器械质量监督管理,保障医疗器械产品使用安全有效,国家食品药品监督管理总局组织对天然胶乳橡胶避孕套、软性接触镜、一次性使用静脉留置针等5个品种184批(台)的产品进行了质量监督抽验。现将抽验结果公告如下:
一、被抽验项目不符合标准规定的医疗器械产品,涉及7家医疗器械生产企业的4个品种8批次。具体为:
(一)软性接触镜1家企业1批次产品。晶硕光学股份有限公司生产的1批次软性亲水接触镜,紫外光区要求(适用时)不符合标准规定。
(二)一次性使用无菌阴道扩张器2家企业3批次产品。陕西富源医用塑料有限公司生产的2批次、江西益康医疗器械集团有限公司生产的1批次一次性使用无菌阴道扩张器,外观不符合标准规定。
(三)天然胶乳橡胶避孕套2家企业2批次产品。河北维妮德橡胶制品有限公司、茂名市江源乳胶制品有限公司生产的各1批次天然胶乳橡胶避孕套,未经老化爆破体积和爆破压力、针孔不符合标准规定。
(四)一次性使用静脉留置针2家企业2批次产品。新乡市驼人医疗器械有限公司生产的1批次一次性使用静脉留置针,紫外吸光度不符合标准规定;江苏阳普医疗科技有限公司生产的1批次一次性使用静脉留置针,流速不符合标准规定。
以上抽验不符合标准规定产品具体情况,见附件1。
二、被抽验项目为标识标签、说明书等项目不符合标准规定的医疗器械产品,涉及4家医疗器械生产企业的2个品种4批(台),具体为:
(一)B型超声诊断设备2家企业2台产品。宜兴市万康医疗电子有限公司生产的1台全数字彩色多普勒超声诊断仪、北京汇影互联科技有限公司生产的1台全数字彩色多普勒超声诊断系统,技术说明书不符合标准规定。
(二)天然胶乳橡胶避孕套2家企业2批次产品。青岛双蝶集团股份有限公司、施梦(天津)乳胶有限公司生产的各1批次天然胶乳橡胶避孕套,包装和标志不符合标准规定。
以上抽验不符合标准规定产品具体情况,见附件2。
三、抽验项目全部符合标准规定的医疗器械产品涉及1个品种172批次,见附件3。
四、对上述抽验中发现的不符合标准规定产品,国家食品药品监督管理总局已要求企业所在地食品药品监督管理部门按照《医疗器械监督管理条例》及《食品药品监管总局办公厅关于进一步加强医疗器械抽验工作的通知》(食药监办械监〔2016〕9号),对相关企业进行调查处理。
相关医疗器械生产企业应对不符合标准规定产品、不符合标准规定项目进行风险评估,根据医疗器械缺陷的严重程度确定召回级别,主动召回并公开召回信息。企业所在地食品药品监督管理部门要对企业召回情况进行监督,未组织召回的应责令召回;如发现不符合标准规定医疗器械产品对人体造成伤害或者有证据证明可能危害人体健康的,可以采取暂停生产、进口、经营、使用的紧急控制措施。
相关省级食品药品监督管理部门要督促企业尽快查明原因,制定整改措施并按期整改到位,有关处置情况于2016年12月30日前向社会公布。
特此公告。
附件:1.国家医疗器械抽验不符合标准规定产品名单
2.国家医疗器械抽验(标识标签说明书等项目)不符合标准规定产品名单
3.国家医疗器械抽验符合标准规定产品名单
食品药品监管总局
2016年11月28日 查看全部
国家医疗器械质量公告(2016年第9期,总第17期)
2016年12月01日 发布
为加强医疗器械质量监督管理,保障医疗器械产品使用安全有效,国家食品药品监督管理总局组织对天然胶乳橡胶避孕套、软性接触镜、一次性使用静脉留置针等5个品种184批(台)的产品进行了质量监督抽验。现将抽验结果公告如下:
一、被抽验项目不符合标准规定的医疗器械产品,涉及7家医疗器械生产企业的4个品种8批次。具体为:
(一)软性接触镜1家企业1批次产品。晶硕光学股份有限公司生产的1批次软性亲水接触镜,紫外光区要求(适用时)不符合标准规定。
(二)一次性使用无菌阴道扩张器2家企业3批次产品。陕西富源医用塑料有限公司生产的2批次、江西益康医疗器械集团有限公司生产的1批次一次性使用无菌阴道扩张器,外观不符合标准规定。
(三)天然胶乳橡胶避孕套2家企业2批次产品。河北维妮德橡胶制品有限公司、茂名市江源乳胶制品有限公司生产的各1批次天然胶乳橡胶避孕套,未经老化爆破体积和爆破压力、针孔不符合标准规定。
(四)一次性使用静脉留置针2家企业2批次产品。新乡市驼人医疗器械有限公司生产的1批次一次性使用静脉留置针,紫外吸光度不符合标准规定;江苏阳普医疗科技有限公司生产的1批次一次性使用静脉留置针,流速不符合标准规定。
以上抽验不符合标准规定产品具体情况,见附件1。
二、被抽验项目为标识标签、说明书等项目不符合标准规定的医疗器械产品,涉及4家医疗器械生产企业的2个品种4批(台),具体为:
(一)B型超声诊断设备2家企业2台产品。宜兴市万康医疗电子有限公司生产的1台全数字彩色多普勒超声诊断仪、北京汇影互联科技有限公司生产的1台全数字彩色多普勒超声诊断系统,技术说明书不符合标准规定。
(二)天然胶乳橡胶避孕套2家企业2批次产品。青岛双蝶集团股份有限公司、施梦(天津)乳胶有限公司生产的各1批次天然胶乳橡胶避孕套,包装和标志不符合标准规定。
以上抽验不符合标准规定产品具体情况,见附件2。
三、抽验项目全部符合标准规定的医疗器械产品涉及1个品种172批次,见附件3。
四、对上述抽验中发现的不符合标准规定产品,国家食品药品监督管理总局已要求企业所在地食品药品监督管理部门按照《医疗器械监督管理条例》及《食品药品监管总局办公厅关于进一步加强医疗器械抽验工作的通知》(食药监办械监〔2016〕9号),对相关企业进行调查处理。
相关医疗器械生产企业应对不符合标准规定产品、不符合标准规定项目进行风险评估,根据医疗器械缺陷的严重程度确定召回级别,主动召回并公开召回信息。企业所在地食品药品监督管理部门要对企业召回情况进行监督,未组织召回的应责令召回;如发现不符合标准规定医疗器械产品对人体造成伤害或者有证据证明可能危害人体健康的,可以采取暂停生产、进口、经营、使用的紧急控制措施。
相关省级食品药品监督管理部门要督促企业尽快查明原因,制定整改措施并按期整改到位,有关处置情况于2016年12月30日前向社会公布。
特此公告。
附件:1.国家医疗器械抽验不符合标准规定产品名单
2.国家医疗器械抽验(标识标签说明书等项目)不符合标准规定产品名单
3.国家医疗器械抽验符合标准规定产品名单
食品药品监管总局
2016年11月28日
Vidacare Corporation对骨髓活检针进行召回2016年12月05日发布
默认分类 • dearhang 发表了文章 • 0 个评论 • 219 次浏览 • 2017-01-10 14:29
下载 打印 分享到新浪微博 分享到腾讯微博 分享到QQ空间 分享到微信
2016年12月05日 发布
泰利福医疗器械商贸(上海)有限公司报告,该公司代理的骨髓活检针(注册证编号:国食药监械(进)字2014第3154576号),由于外部无菌包装存在潜在的不完全密封。其生产商Vidacare Corporation对该产品进行主动召回,该公司称本次召回产品未在中国销售。请各省、自治区、直辖市食品药品监督管理局加强对此类产品的监督管理。
查看全部
一次性医疗器械真的一次性使用吗?
默认分类 • dearhang 发表了文章 • 0 个评论 • 210 次浏览 • 2017-01-10 14:27
一、 未使用过,发现过期后重新打包进行灭菌
代表物品:一次性气管插管、一次性口咽通道、一次性牙垫等
原因:科室使用量特别少的科室(有的科室或基层医院甚至一年都不曾使用)存在重复灭菌,但护理抢救车又是必备物品,所以,对未使用过的考虑成本只能重新打包灭菌。
二、 开错型号,或打开后发现型号不对(医生及护士)
代表物品:猪尾巴管、支架管、斑马导丝等
原因:由于患者的特殊性,按照常规选择型号后与患者又不符合,只能再打开另一型号的,但之前的型号患者又不能都收费,所以考虑成本对之前开错型号,未使用的重新打包灭菌。
三、 费用昂贵,无法收回成本
代表物品:手术室超声刀、立克速等(成本近万元以上)
原因:物品成本很高,有的万元以上,但基本收费不到20%,所以成本收不上,只能重复灭菌使用。 查看全部
一、 未使用过,发现过期后重新打包进行灭菌
代表物品:一次性气管插管、一次性口咽通道、一次性牙垫等
原因:科室使用量特别少的科室(有的科室或基层医院甚至一年都不曾使用)存在重复灭菌,但护理抢救车又是必备物品,所以,对未使用过的考虑成本只能重新打包灭菌。
二、 开错型号,或打开后发现型号不对(医生及护士)
代表物品:猪尾巴管、支架管、斑马导丝等
原因:由于患者的特殊性,按照常规选择型号后与患者又不符合,只能再打开另一型号的,但之前的型号患者又不能都收费,所以考虑成本对之前开错型号,未使用的重新打包灭菌。
三、 费用昂贵,无法收回成本
代表物品:手术室超声刀、立克速等(成本近万元以上)
原因:物品成本很高,有的万元以上,但基本收费不到20%,所以成本收不上,只能重复灭菌使用。
临床常用无菌物品开启日期及更换时间
默认分类 • dearhang 发表了文章 • 0 个评论 • 425 次浏览 • 2017-01-10 14:23
1、开启的无菌液体24小时?与开启的静脉输入用无菌液体须注明开启日期和时间,放置时间超过2小时后不得使用不相符,应改为2小时;
2、开启的原装碘伏小瓶,应加上酒精(一次性小包装的瓶装碘酒、酒精)1周;
3、开启快速手消毒液酒精1个月、碘伏2个月;
4、开启的无菌棉签、棉球、纱布等,不是4小时,应为24小时;
4、无菌持物钳、无菌盘,还应加上裸露灭菌后存放器械4小时
部分依据:
《基层医疗机构医院感染管理基本要求》
四、重点环节
(一)安全注射
4.抽出的药液、开启的静脉输入用无菌液体须注明开启日期和时间,放置时间超过2小时后不得使用;启封抽吸的各种溶媒超过24小时不得使用。灭菌物品(棉球、纱布等)一经打开,使用时间不得超过24小时,提倡使用小包装。
5.盛放用于皮肤消毒的非一次性使用的碘酒、酒精的容器等应密闭保存,每周更换2次,同时更换灭菌容器。一次性小包装的瓶装碘酒、酒精,启封后使用时间不超过7天。
GB,27950-2011 手消毒剂卫生要求
4.2.5 开瓶后使用有效期
4.2.5.1 在使用有效期内消毒剂有效含量不低于成品标示有效含量的下限值。
4.2.5.2 易挥发性的醇类产品开瓶后的使用期不超过30d。
4.2.5.3 不易挥发的产品开瓶后的使用期不超60d。
医疗机构口腔诊疗器械消毒技术操作规范
第十四条 根据采用的消毒与灭菌的不同方式对口腔诊疗器械进行包装,并在包装外注明消毒日期、有效期。
采用快速卡式压力蒸汽灭菌器灭菌器械,可不封袋包装,裸露灭菌后存放于无菌容器中备用;一经打开使用,有效期不得超过4小时。
查看全部
1、开启的无菌液体24小时?与开启的静脉输入用无菌液体须注明开启日期和时间,放置时间超过2小时后不得使用不相符,应改为2小时;
2、开启的原装碘伏小瓶,应加上酒精(一次性小包装的瓶装碘酒、酒精)1周;
3、开启快速手消毒液酒精1个月、碘伏2个月;
4、开启的无菌棉签、棉球、纱布等,不是4小时,应为24小时;
4、无菌持物钳、无菌盘,还应加上裸露灭菌后存放器械4小时
部分依据:
《基层医疗机构医院感染管理基本要求》
四、重点环节
(一)安全注射
4.抽出的药液、开启的静脉输入用无菌液体须注明开启日期和时间,放置时间超过2小时后不得使用;启封抽吸的各种溶媒超过24小时不得使用。灭菌物品(棉球、纱布等)一经打开,使用时间不得超过24小时,提倡使用小包装。
5.盛放用于皮肤消毒的非一次性使用的碘酒、酒精的容器等应密闭保存,每周更换2次,同时更换灭菌容器。一次性小包装的瓶装碘酒、酒精,启封后使用时间不超过7天。
GB,27950-2011 手消毒剂卫生要求
4.2.5 开瓶后使用有效期
4.2.5.1 在使用有效期内消毒剂有效含量不低于成品标示有效含量的下限值。
4.2.5.2 易挥发性的醇类产品开瓶后的使用期不超过30d。
4.2.5.3 不易挥发的产品开瓶后的使用期不超60d。
医疗机构口腔诊疗器械消毒技术操作规范
第十四条 根据采用的消毒与灭菌的不同方式对口腔诊疗器械进行包装,并在包装外注明消毒日期、有效期。
采用快速卡式压力蒸汽灭菌器灭菌器械,可不封袋包装,裸露灭菌后存放于无菌容器中备用;一经打开使用,有效期不得超过4小时。